M2R ADAM
From silico.biotoul.fr
(→Etape 3: identification in silico des clones recombinants positifs) |
(→Etape 3: identification in silico des clones recombinants positifs) |
||
| Line 91: | Line 91: | ||
Le clonage et la transformation d’''E. coli'' ont été réalisés avec le vecteur pVX_CBEL. Les colonies bactériennes ont été étalées sur milieu sélectif. L’ADN plasmidique de 3 clones recombinants positifs putatifs a été extrait et digéré via les 2 enzymes de restriction utilisées pour le clonage. Afin de définir le profil de restriction d'un clone recombinant positif, une digestion in silico du vecteur pVX_CBEL peut-être réalisée. | Le clonage et la transformation d’''E. coli'' ont été réalisés avec le vecteur pVX_CBEL. Les colonies bactériennes ont été étalées sur milieu sélectif. L’ADN plasmidique de 3 clones recombinants positifs putatifs a été extrait et digéré via les 2 enzymes de restriction utilisées pour le clonage. Afin de définir le profil de restriction d'un clone recombinant positif, une digestion in silico du vecteur pVX_CBEL peut-être réalisée. | ||
| - | |||
'''Réaliser une digestion in silico (profil de restriction)''' | '''Réaliser une digestion in silico (profil de restriction)''' | ||
| Line 109: | Line 108: | ||
'''Q4''' | '''Q4''' | ||
*Que faut-il faire pour la suite des expériences ? | *Que faut-il faire pour la suite des expériences ? | ||
| - | |||
==Etape 4: définition d'amorces== | ==Etape 4: définition d'amorces== | ||
Revision as of 13:10, 14 September 2018
Introduction
Le but de ce TD est de se familiariser avec les concepts et les outils de biologie moléculaire nécessaires à l’analyse de séquences nucléiques (clonage, analyse de restriction, alignement...) par utilisation de logiciel dédié.
La version gratuite académique de BenchLing sera utilisé pour ce TD. D'autres logiciels comme Serial Cloner , CLC, / pDRAW32 sont également disponibles pour réaliser ce type d'analyse.
Contexte Scientifique du TD
Une étude biochimique a permis d’isoler une protéine pariétale de l’oomycète Phytophthora parasitica, parasite racinaire de nombreuses solanacées. Cette protéine, nommée CBEL (Celluose-Binding Elicitor Lectin), est reconnue par la plante (=effecteur), entraînant une mort localisée de certaines cellules végétales. Pour poursuivre les études une protéine recombinante doit etre produite. On se propose ici de cloner l'ADNc de CBEL dans le vecteur d’expression pVX (virus X de la pomme de terre) pour obtenir le vecteur pVX-CBEL.
Différentes étapes seront réalisées pour mener à bien ce projet.
Etape 1 : choix des enzymes de restriction adaptées pour le clonage dans le vecteur pVX Etape 2 : création d'une carte du plasmide pVX-CBEL Etape 3 : identification in silico des clones recombinants positifs Etape 4 : définition d'amorce Etape 5 : séquençage Etape 6 : analyse des résultats
Installation de BenchLing et prise en main de l'outil
- Connectez vous à BenchLing, et créez vous un compte sur la version 'Académique' (For Academia > Sign In).
- Regardez les principales fonctions du logiciel en travaillant avec la carte du plasmide pBR322
- Créez-vous un projet 'TDM2' ou vous sauvegarderez toutes vos données de ce TD
Création de projet Dans benchling, en haut a gauche, cliquez sur le logo 'valise' Puis sur le signe +, et identifiez votre projet sous le nom 'TDM2' Notez que votre projet peut-être partagé avec des collaborateurs
Etape 1: choix des enzymes de restriction adaptées pour le clonage dans le vecteur pVX
- L'ADNc pleine taille de CBEL est présent dans un vecteur nommé pBlueScript_SK (pBSK, 3 736pb), présentant un gène codant une résistance à l’ampicilline.
- Le carte du vecteur pVX d'expression, et son site multiple de clonage (MCS), ainsi que la séquence partielle (MCS + insert CBEL) du plasmide pBSK_CBEL sont disponibles ici.
Q1
- Décrire les principales étapes du clonage à réaliser.
- Indiquez comment vous sélectionnez les clones recombinants.
- Afin d’identifier les sites de restriction compatible entre le vecteur d'entrée pBSK_CBEL comportant l'insert CBEL et le vecteur de destination pVX, nous allons visualiser les différentes cartes de restriction via BenchLing.
Créer la carte du vecteur de destination pVX dans BenchLing Placez vous dans votre projet 'TDM2' (cliquez sur le logo 'valise', colonne de gauche) Cliquez sur le signe + (colonne de gauche)> DNA sequence > New DNA Sequence > Entrez le nom de votre fragment d'ADN (i,e pVX_MCS) > Circular > Copier coller votre séquence (partie gauche de la zone de travail)
Identifiez les sites de restriction à coupure unique sur le MCS du pVX Cliquez sur le logo 'ciseau' (colonne de droite) Identifiez les enzymes présentant un site de coupure unique, et disponible chez le fournisseur Proméga
- Réalisez la même démarche avec la zone du MCS du vecteur pBSK présentant l'insert CBEL (ie pBSK_MCS_CBEL)
Q2
- quels sont les sites de restrcition utilisables avec des enzymes de restriction de Proméga, utilisables pour le clonage de l'insert CBEL dans le vecteur pVX ?
Etape 2: création d'une carte du plasmide pVX-CBEL
L'identification des clones recombinants contenant l'insert CBEL peut s'effectuer à la paillasse par une digestion enzymatique des clones candidats pVX_CBEL ou encore par PCR.
Pour prédire la taille des inserts libérés par analyse de restriction, une digestion in silico du vecteur recombinant pVX_CBEL peut-réalisée. Il faut donc créer la carte du nouveau plasmide.
Utilisation de BenchLing pour créer des cartes de plasmide Obtenez la carte du plasmide pVX dont la séquence et les caractéristiques sont disponibles sur ce lien: pVX sequence Vous pouvez ouvrir ce fichier directement dans BenchLing en cliquant sur + > DNA Sequence > Import DNA Sequence Vous pouvez demander une annotation automatique du vecteur dans colonne de droite le logo 'enveloppe' Vous pouvez aussi ajouter manuellement certaines annotation. Indiquez par exemple la cassette ampicilline (AMPI) sur votre vecteur en position [31-846] du brin complémentaire
Il faut maintenant réaliser le clonage in silico de l'insert CBEL contenu dans le MCS du pBSK dans le vecteur de destination pVX pour en générer la carte
Utilisation de BenchLing pour créer des cartes de plasmide apres clonage in silico En étant sur la carte du vecteur pVX, cliquez sur Assembly Wizzard (en bas a droite) > Create New Assembly >Digest and Ligate > Start En bas de votre écran, une fenêtre SET FRAGMENT, BACKBONE et INSERT se sont ouvertes: c'est ici qu'il faut indiquer les fragments a cloner Sélectionner la zone d'intérêt du vecteur pVX (ie à l'extérieur des 2 sites de restriction, clic droit) (fragment) Faites la même chose avec l'insert CBEL dans le fichier pBSK_MCS_CBEL (insert) Si tout est bon, un logo vert apparait en bas a droite: cliquez dessus puis Assemble Enregistrez votre travail dans le projet TDM2 Renommez le plasmide obtenu en 'pVX_CBEL' pour cela cliquez sur le logo 'horloge' (colonne de droite)
- En cas de nécessité vous pouvez télécharger le fichier de correction pVX_CBEL.
Etape 3: identification in silico des clones recombinants positifs
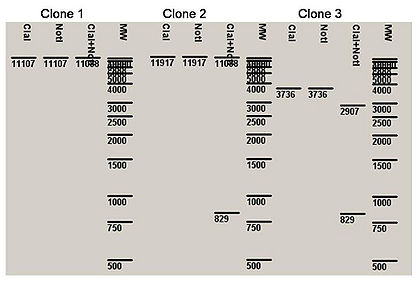
Le clonage et la transformation d’E. coli ont été réalisés avec le vecteur pVX_CBEL. Les colonies bactériennes ont été étalées sur milieu sélectif. L’ADN plasmidique de 3 clones recombinants positifs putatifs a été extrait et digéré via les 2 enzymes de restriction utilisées pour le clonage. Afin de définir le profil de restriction d'un clone recombinant positif, une digestion in silico du vecteur pVX_CBEL peut-être réalisée.
Réaliser une digestion in silico (profil de restriction) Sur le fichier pVX_CBEL, réalisez une digestion avec les 2 enzymes d'intérêt. Pour cela cliquer sur le logo ciseau (a droite) > sélectionnez vos enzymes > Run Digest Visualiser le gel d'électrophorèse en cliquant sur l'onglet 'virtuel digest' (juste en dessous du nom du fichier) Indiquez les tailles des fragemnts obtenus après double digestion
Ci-dessous le profil de restriction des 3 clones, est présenté :
Q3
- Comment peut-on interpréter ces résultats ?
Q4
- Que faut-il faire pour la suite des expériences ?
Etape 4: définition d'amorces
Pour valider les clones positifs, une vérification par séquençage de la zone d'intérêt est nécessaire. Il faut donc disposer d'amorces (oligonuclétoides) adéquats pour le séquençage. Différents logiciels sont disponibles pour définir des amorces dont PrimerBlastqui présente l'avantage de combiner un logiciel de définition de primer disponible sur le Web (Primer 3), à une analyse de type Blast de vos primers sur les banques du NCBI pour en vérifier leurs spécificités. Vous pouvez aussi définir des oligonucléotides sur Benchling
Utilisation de BenchLing pour l'obtention d'oligonucléotides Copier-coller la séquence du vecteur pVX_CBEL au format fasta, dans le grand cadre blanc en haut de page Définir dans "range" les positions de la zone à amplifier Définir la taille de l'insert à amplifier (sans importance pour le séquençage, indispensable pour une PCR ou qPCR) Définir le Tm de vos primers (paramètres par défaut) Sélectionnez les banques à utiliser pour l'analyse Blast (Organism : all, database : nr)
Utilisation de Primer-Blast pour l'obtention d'oligonucléotides Copier-coller la séquence du vecteur pVX_CBEL au format fasta, dans le grand cadre blanc en haut de page Définir dans "range" les positions de la zone à amplifier Définir la taille de l'insert à amplifier (sans importance pour le séquençage, indispensable pour une PCR ou qPCR) Définir le Tm de vos primers (paramètres par défaut) Sélectionnez les banques à utiliser pour l'analyse Blast (Organism : all, database : nr)
Modification du format de séquences (fasta, texte..) Utilisez le logiciel SeqRet Copier-coller la séquence pVX_CBEL générée avec pDRAW32 dans le cadre Choisir le format de sortie "pearson/fasta" Sauvegarder votre séquence pVX_CBEL, format fasta, pour l'utilisation dans Primer_Blast
Q5
- Définir un couple d'amorce permettant le séquençage de la zone d'intérêt en 5' et 3' (jonction vecteur/insert ; insert CBEL ; jonction insert / vecteur) de pVX_CBEL